Alguns átomos são estáveis, ou seja, pouco reativos. Já outros não podem ficar isolados. Precisam se ligar a outros elementos. As forças que mantêm os átomos unidos são fundamentalmente de natureza elétrica e são chamadas de Ligações Químicas.
Toda ligação envolve o movimento de elétrons nas camadas mais externas dos átomos, mas nunca atinge o núcleo.
De todos os elementos químicos conhecidos, apenas 6, os gases nobres ou raros, são encontrados na natureza na forma de átomos isolados. Os demais se encontram sempre ligados uns aos outros, de diversas maneiras, nas mais diversas combinações.
Regra do Octeto – Os elementos químicos devem sempre conter 8 elétrons na última camada eletrônica ou camada de valência. Na camada K pode haver no máximo 2 elétrons. Desta forma os átomos ficam estáveis, com a configuração idêntica à dos gases nobres.
Há três tipos de ligações químicas:- Ligação Iônica – perda ou ganho de elétrons.
- Ligação Covalente – compartilhamento de elétrons.
- Ligação Metálica – átomos neutros e cátions mergulhados numa "nuvem" de elétrons.
LIGAÇÃO IÔNICA
A ligação iônica é resultado da alteração entre íons de cargas elétricas contrárias (ânions e cátions).
METAL + NÃO-METAL → LIGAÇÃO IÔNICA
Exemplo: Na e ClNa (Z = 11) K = 2 L = 8 M = 1
Cl (Z = 17) K = 2 L = 8 M = 7
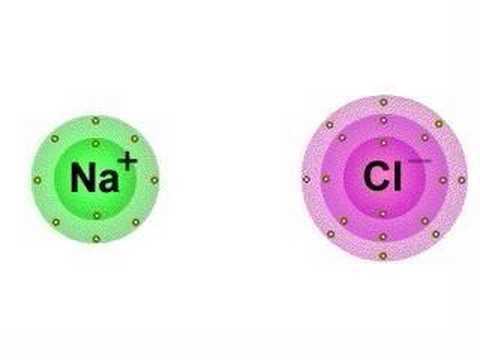
O Na quer doar 1 é → Na+ (cátion)
O Cl quer receber 1 é → Cl – (ânion)
LIGAÇÃO COVALENTE
A ligação covalente, geralmente é feita entre os não-metais e não metais, hidrogênio e não-metais e hidrogênio com hidrogênio.Esta ligação é caracterizada pelo compartilhamento de elétrons.Exemplo: H (Z = 1) K = 1H – H → H2
O traço representa o par de elétrons compartilhados.

Fórmula Eletrônica ou de Lewis
Cl – Cl
Fórmula Estrutural
Cl2
Fórmula Molecular
LIGAÇÃO METÁLICA
Ligação metálica é a ligação entre metais e metais. Formam as chamadas ligas metálicas que são cada vez mais importantes para o nosso dia-a-dia. A consideração de que a corrente elétrica é um fluxo de elétrons levou à criação da Teoria da Nuvem Eletrônica ou Teoria do “Mar” de elétrons.Pode-se dizer que o metal seria um aglomerado de átomos neutros e cátions, mergulhados numa nuvem ou “mar” de elétrons livres. Esta nuvem de elétrons funcionaria como a ligação metálica, que mantém os átomos unidos.
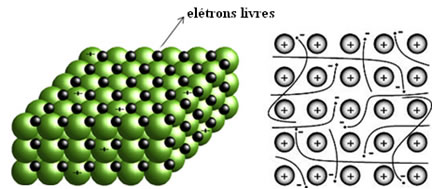
Fonte: http://www.soq.com.br/conteudos/ef/ligacoesquimicas/index.php

Bom, entre as aulas de química e de fisica, eu goto mais de química, porque eu acho mais interessante, rsrsrs, mas fisica é legal... Confesso que eu entro pouco no blog, mas sempre quando eu entro eu presto atenção em cada detalhe, pq eu acho que o que eu ñ aprendo na aula, lendo um pouco do que tem no blog... acho q facilita um pouco!!! :)
ResponderExcluirO fundo desse site podia ser outro porque tá ruim pra ler com esse fundo ,mais obrigada
ResponderExcluir